Ავტორი:
Laura McKinney
ᲨᲔᲥᲛᲜᲘᲡ ᲗᲐᲠᲘᲦᲘ:
8 ᲐᲞᲠᲘᲚᲘ 2021
ᲒᲐᲜᲐᲮᲚᲔᲑᲘᲡ ᲗᲐᲠᲘᲦᲘ:
1 ᲘᲕᲚᲘᲡᲘ 2024

ᲙᲛᲐᲧᲝᲤᲘᲚᲘ
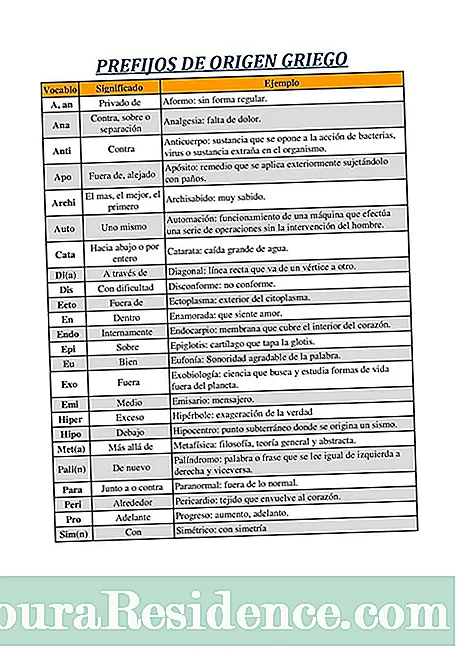
ჰიდრიდები ისინი წარმოადგენენ ქიმიურ ნაერთებს, რომლებიც აერთიანებენ წყალბადის ატომებს (რომელთა დაჟანგვის მდგომარეობა უმეტეს შემთხვევაში არის -1) და მათი მოლეკულის პერიოდული სისტემის სხვა ელემენტის ატომები.
აღიარებულია ჰიდრიდების სამი კატეგორია:
- მეტალიკი მეტალიკი: ესენი არიან ისეთები, რომლებიც წარმოიქმნება ტუტე და ტუტე – მიწიანი ელემენტებით, ანუ მათთან, რომლებიც ელემენტთა პერიოდული სისტემის მარცხნივ მარცხნივ არიან. ისინი არამდგრადი ნაერთებია, რომლებიც ავლენენ გამტარობას. წყალბადი მათში გვხვდება, როგორც ჰიდრიდის იონი H¯. ამ ჯგუფში შეიძლება განასხვავონ ჰიდრიდები, რომლებიც ქმნიან ყველაზე მეტ ელექტროპოზიტიურ მეტალებს (1 და 2 ჯგუფებისგან); ამ ჰიდრიდებს ხშირად მარილიან მარილს უწოდებენ. მარილიანი ჰიდრიდები ზოგადად არის თეთრი ან ნაცრისფერი მყარი ნივთიერებები, რომლებიც მიიღება მაღალ ტემპერატურაზე ლითონის წყალბადთან პირდაპირი რეაქციით.
- აქროლადი ან არალითონური ჰიდრიდები:ესენი არიან ისინი, რომლებიც წარმოიქმნება არალითონური ელემენტებით, მაგრამ მცირე ელექტრონეგატივით, კერძოდ, აზოტით, ფოსფორით, დარიშხანით, სტიბიუმით, ბისმუთით, ბორით, ნახშირბადით და სილიციუმით: ყველა მათგანი იღებს სპეციფიკურ სახელებს, ზოგადი ნომენკლატურის მიღმა; ისინი ყველა მეტალოიდებს ან მეტალებს p ბლოკიდან. მათ ასევე შეიძლება მოლეკულური ან კოვალენტური ჰიდრიდები ვუწოდოთ, რადგან მათ აქვთ კოვალენტური ბმა. ისინი ქმნიან საკმაოდ განსაკუთრებული ასპექტების მინერალებს. Silane, ამ ჯგუფის ჰიდრიდი, სულ უფრო მეტ ინტერესს იწვევს ნანონაწილაკების წარმოებაში მისი მნიშვნელობის გამო.
- წყალბადის ჰიდრიდები:(ასევე მას უბრალოდ ჰიდრაციდებს უწოდებენ) შეესაბამება წყალბადის ჰალოგენთან (ფტორს, ქლორს, ბრომს ან იოდს) ან ანტიგენურ ელემენტს (ჟანგბადი, გოგირდი, სელენი, ტელურიუმი); მხოლოდ ამ უკანასკნელ შემთხვევაში მოქმედებს წყალბადის დაჟანგვის დადებითი რიცხვი (+1) და სხვა ელემენტია ის, რომელიც მუშაობს უარყოფითი დაჟანგვის რიცხვით (-1 ჰალოგენებში, -2 ამფოგენებში).
ჰიდრიდების მაგალითები
- ნატრიუმის ჰიდრიდი (NaH)
- ფოსფინი (PH3)
- ბარიუმის ჰიდრიდი (BaH2)
- ბისმუტინი (Bi2S3)
- პერმანგანული ჰიდრიდი (MnH7)
- ამიაკი (NH3)
- არსინი (AsH3)
- სტიბინიტი ან ანტიმონიტი
- ჰიდრობრომმჟავა (HBr)
- ბორანო (BH3)
- მეთანი (CH4)
- სილანე (SiH₄)
- ჰიდროფლორმჟავა (HF)
- მარილმჟავა (HCl)
- შავი ჰიდრიდი (FeH3)
- ჰიდროიოდინის მჟავა (HI)
- წყალბადის სულფიდი (H2S)
- სელენჰიდრინის მჟავა (H2Se)
- ტელურჰიდრინის მჟავა (H2Te)
- ლითიუმის ჰიდრიდი (LiH)
ჰიდრიდების გამოყენება
ჰიდრიდების გამოყენებებს მოიცავს საშრობი და რედუქტორები, ზოგი გამოიყენება, როგორც სუფთა წყალბადის წყაროები.
კალციუმის ჰიდრიდი განსაკუთრებით სასარგებლოა ორგანული გამხსნელი საშრობი საშუალება. ნატრიუმის ჰიდრიდი მოითხოვს დიდ სიფრთხილით მოპყრობას, რადგან იგი მძაფრად რეაგირებს წყალთან და აალდება.
თუ ამ ჰიდრიდის ანთების გამო ხანძარი გაჩნდა, მის ჩასაქრობად ნუ გამოიყენებთ წყალს, რადგან იგი წარმოქმნიდა უფრო მეტ ცეცხლს. ეს ხანძრები ჩაქრეს ფხვნილი ცეცხლმაქრები.